600家企业、533个品种,2020年仿制药一致性评价进展如何?
- 2020-09-14 15:20
- 作者:柯晗
- 来源:火石创造
截至2020年8月,全国已有600家企业积极参与到仿制药一致性评价中,共533个品种、2319个药品获得受理。随着一致性评价不断深入,地方发展将面临更激烈的竞争挑战,但同时也存在抢占市场、倒逼产业转型升级的新机遇。
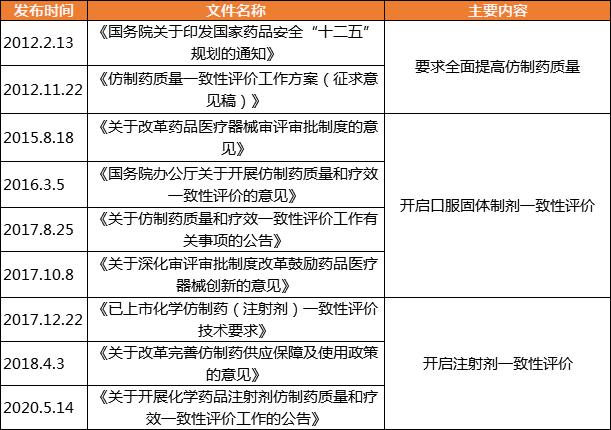
仿制药一致性评价历程
长期以来,仿制药占据我国90%以上的药品市场份额,仿制药质量与民众健康息息相关。为了提高仿制药质量,保证人民用药安全有效,2012年,国家提出了开展仿制药一致性评价的计划,要求仿制药和原研药达到相同的治疗效果;2016年,计划正式启动,口服固体制剂一致性评价率先开启;2020年,注射剂一致性评价正式开启,一致性评价工作持续深入。
目前,仿制药一致性评价针对的仍为化学仿制药。仿制药一致性评价工作,保障了仿制药在质量和疗效上与原研药一致,在临床上实现与原研药相互替代,不仅有利于节约医疗费用,也有助于提升我国仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。
表1:仿制药一致性评价相关政策列表
仿制药一致性评价进展
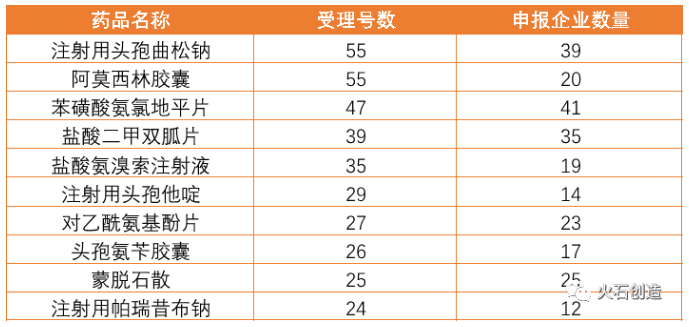
1.仿制药受理数超2300个,热门大品种企业竞争空前激烈。
自2016年颁布《开展仿制药质量和疗效一致性评价的意见》以来,各大仿制药企积极响应。截至2020年8月底,对于已上市仿制药,共有533个品种,2319个产品申请获得受理。
申报排名前三的品种分别为:阿莫西林胶囊、注射用头孢曲松钠和苯磺酸氨氯地平片,其中阿莫西林胶囊和注射用头孢曲松钠申报数量并列第一,均为55个,而苯磺酸氨氯地平片的竞争企业数达到41家,竞争空前激烈。
表2:一致性评价申请受理数量前十的药品
2.一致性评价企业数量达到600家,齐鲁、科伦、石药批件数名列前茅。
截至2020年8月底,申报一致性评价的企业达到600家(区分总公司及其子公司),其中申请数量最多的企业为齐鲁制药(总公司),批件数达到61件,涉及43个药物品种。
从企业申报情况来看,大型仿制药企业均设立子公司,积极布局推动一致性评价,抢占市场。如科伦药业与其七家子公司共申请78个批件,石药集团依托旗下四家子公司共申请59个批件。
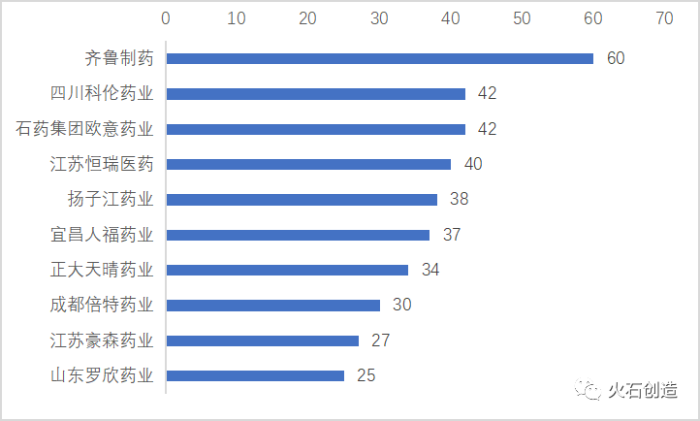
申请一致性评价数量排名前十的企业主体
3.临床试验稳步推进,注射剂仿制药临床试验集中
截至2020年8月底,CDE登记仿制药临床试验已完成和正在进行的项目达到1290项,其中已完成项目911项,主要集中于化学注射剂仿制药,排名前五的均为注射剂,分别是注射用头孢曲松钠、盐酸氨溴索注射液、注射用帕瑞昔布钠、注射用头孢他啶、注射用奥美拉唑钠。
4.长三角实力雄厚,江苏省申报企业数量排名第一
聚焦申报一致性评价的600家仿制药企业,主要分布在江苏、广东、山东、浙江等省份,4省企业数占比超过36%,其中江苏省企业数量达到73家,排名第一。
一致性评价下地方发展路径分析
一致性评价的发展给各省份化药产业带来了挑战,也带来了机会。当前形势下,地方发展路径可从以下几个方面展开:
1.鼓励企业积极参与一致性评价
为顺应国家不断深化的带量采购等政策,地方政府一要鼓励企业积极参与仿制药一致性评价,并给予相应补贴;二要推动规模化C(D)MO平台建设,综合控制生产成本,灵活应对带量采购的入围结果以及MAH制度下的生产外包,避免产能损失。
具体措施表现在鼓励本地大型有实力的制药企业自主搭建C(D)MO平台,政府给予相应补贴;或当地政府牵头搭建C(D)MO平台,引入第三方企业运营等。
2.鼓励企业布局高仿、首仿、难仿药
对于企业基础好的地区,可鼓励企业积极拓展产品线,支持企业发展高仿、难仿和首仿药,依托当地仿制药存量企业和引进的增量企业,开展临床急需、供应短缺、疗效确切、新专利到期药物的仿制开发,提高患者用药可及性,提升企业竞争力,抢占新市场。
3.保障上游原料药供给,推动企业升级转型
仿制药原料药的充足供应对仿制药产业的发展至关重要,对于原料药基础较好的地区,可推动当地原料药企业开发特色原料药、专利原料药,并鼓励企业向仿制药制剂企业转型发展。
对于原料药供给不足且原料药产业发展受限的地区,应支持跨区域原料药-制剂一体化产业布局,帮助企业打通进口通道,以保障当地仿制药企业的原料药供给。(火石创造)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐