中国式药品监管现代化建设迈出坚实步伐——国家药监局2022年工作综述
- 2023-01-05 16:15
- 作者:落楠
- 来源:中国医药报
2022年,是党和国家事业发展进程中极为重要的一年。党的二十大胜利召开,吹响了全面建设社会主义现代化国家、全面推进中华民族伟大复兴的奋进号角。
这一年,国家药监局奋力做好药品监管工作,以药品一域之稳为全国大局之稳作出更大贡献。一年来,药品安全专项整治行动在全国深入开展,药品医疗器械审评审批制度改革红利持续释放,防疫药械审评审批和质量监管取得新成效,药品监管能力进一步提升。中国疫苗国家监管体系(NRA)再一次通过世界卫生组织(WHO)评估,国产质子治疗设备实现“零突破”,首个按古代经典名方目录管理的中药复方制剂获批上市……药品监管的答卷上定格了一个个精彩瞬间。
这一年,药品监管工作迈上新台阶,为建立新药品监管体制以来的五年画上了圆满句号,也在中国式药品监管现代化道路上迈出坚定步伐。
党建引领 凝聚奋进力量
2022年10月16日上午10时,党的二十大隆重开幕。在国家药监局办公楼二楼会议厅,大屏幕前收听收看的党员干部聚精会神、认真聆听开幕会。在全国各地,药监系统党员干部职工同样满怀激情,收看开幕会实况。开幕会后,药监系统迅速掀起学习贯彻热潮。
2022年10月24日,国家药监局召开党组会议,传达学习党的十九届七中全会和二十大、二十届一中全会精神,研究部署学习贯彻措施;10月25日,国家药监局召开干部大会,传达学习党的二十大精神,对学习宣传贯彻二十大精神进行动员部署;11月10日,国家药监局召开学习宣传贯彻党的二十大精神集中轮训班开班动员会议……一次次部署、一轮轮学习,紧锣密鼓,持续推进,切实把药监系统干部职工的思想和行动统一到党的二十大精神上来,把智慧和力量统一到党的二十大确定的目标任务上来。
回首2022年,迎接党的二十大胜利召开、学习宣传贯彻党的二十大精神,是国家药监局全年党建工作主线。国家药监局强化政治引领,走好第一方阵,将初心使命转化为前进动力,扛起使命担当,推进工作落实,取得实际成效。
这一年,在北京市北露园1号,国家药监局机关持续高效运转,一份份工作文件由此发出、高位部署,各级药监部门全面落实、真抓实干,全力服务保障疫情防控工作大局,深入推进药品医疗器械审评审批制度改革,积极服务国家重大区域战略部署,扎实做好援藏援疆工作,强化帮扶助力乡村振兴。
这一年,党史学习教育常态化长效化,全面从严治党向纵深发展。国家药监局党组和中央纪委国家监委驻市场监管总局纪检监察组召开两次专题会议,就全面从严治党进行专题会商。国家药监局及时将驻总局纪检监察组工作建议进行任务分解,采取有效措施,认真抓好落实。
这一年,基层党建工作创特色、出实效、上水平。中央和国家机关工委命名一批“中央和国家机关‘四强’党支部”,国家药监局11个党支部榜上有名。市场监管总局直属机关党委印发《关于命名总局“四强”党支部的决定》,国家药监局22个党支部获得命名。在药品监管工作的各个支线上,党组织战斗堡垒作用和党员先锋模范作用得到充分发挥,党旗在药监战线上高高飘扬。
服务大局 展现药监担当
2022年12月30日,在2022 年最后一个工作日,国家药监局的网站仍在频繁更新监管动态。
2022年12月29日,国家药监局应急附条件批准新冠病毒治疗药物莫诺拉韦胶囊进口注册。30日,国家药监局通过快速审评通道,批准布洛芬混悬液等12个新冠病毒感染对症治疗药物上市;同日,经国家药监局审查,批准又一款新冠病毒抗原检测试剂产品。一条条信息背后,浓缩着国家药监局全力服务保障疫情防控工作大局的不懈努力。
新冠肺炎疫情发生以来,国家药监局闻令而动,带领全系统连续打好疫情防控所需药械审评审批和质量监管的大仗硬仗。2022年,抗疫仍在进行时,国家药监局慎终如始、再接再厉,和有关部门通力协作,一手抓创新研发,一手抓质量监管,以实际行动展现药监担当作为、诠释绝对忠诚。
国家药监局坚持研审联动,附条件批准我国首个重组新型冠状病毒蛋白疫苗上市注册申请、首个国产口服小分子药物增加治疗新冠肺炎适应症,批准相关治疗药物进口注册。我国累计附条件批准5个新冠病毒疫苗上市,其中3个被列入世界卫生组织紧急使用清单,另有多个新冠病毒疫苗经有关部门论证同意后纳入紧急使用。
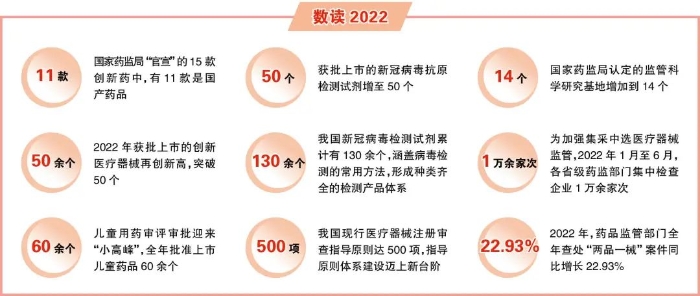
保障防疫需要,国家药监局跑出审评审批加速度。2022年12月以来,我国已批准新冠病毒抗原检测试剂的列表不断刷新,39个、40个、42个、44个、46个、47个……截至12月31日,国家药监局已批准50个新冠病毒抗原检测试剂产品。我国新冠病毒检测试剂累计有130多个,涵盖了病毒检测的常用方法,形成了种类齐全的检测产品体系。
疫情防控常态化下,作为“武器”的药械产品的质量监管须臾不可懈怠。2022年,国家药监局多次部署、持续加强新冠病毒疫苗及治疗药物全链条动态监管,将其作为重点工作贯穿全年。1月召开的2022年全国药品监督管理暨党风廉政建设工作会议即强调,要全面加强疫情防控药械质量安全监管。2022年12月以来,国家药监局召开视频会议,部署进一步加强新冠病毒疫苗及治疗药物的生产供应、流通使用等各环节、全链条的监管,要求加强新冠病毒抗原检测试剂质量安全监管。
回顾2022年,国家药监局强化药品生产流通监管、严查违法违规行为,要求广大医药企业时刻绷紧质量安全这根弦,部署各级药品监管部门加大监督检查和质量抽检力度,加强网上网下全方位监管。各地药监人员奔走在监管一线,履职尽责,全力保障人民群众用药安全。
严字当头 筑牢安全防线
2022年,国家药监局公布3批23个药品安全专项整治典型案例,通报7起医疗美容药品医疗器械违法案例,通报9个彩色隐形眼镜违法案例。在药监系统查处违法违规案件的行动中,严字当头的导向得到鲜明的体现。
药品安全专项整治行动无疑是2022年药品监管工作的重点。国家药监局在2022年全国药品监督管理暨党风廉政建设工作会议上部署深入开展药品安全专项整治行动,此后多次召开专门会议和分领域部署推进会,推动专项整治走深走实。
国家药监局党组成立药品安全专项整治工作领导小组,组建专门工作组,与市场监管总局联合印发专项整治工作方案,对各地监管部门持续跟踪问效。针对药品、医疗器械、化妆品领域群众反映强烈的问题,查处一批大案要案,公布一批典型案例,移送一批犯罪线索,消除一批风险隐患……全国药监系统迅速行动落实,形成雷霆之势。
2022年6月,国务院办公厅成立集中打击整治危害药品安全违法犯罪工作领导小组,将领导小组办公室设在国家药监局,专项整治提档升级。
一年来,国家药监局力促全系统形成“一盘棋”工作格局、加强与相关部门协同联动,各级药品监管部门突出严查违法、严控风险的主线,深入开展药品安全专项整治行动,严惩重处力度加大,风险排查扎实有力,建章立制步伐加快,部门协作显著增强,专项整治各项任务有效落地,全年查处“两品一械”案件同比增长22.93%,有力震慑了违法违规行为。
专项整治是集中时间和监管资源着力解决区域性或行业性突出问题、遏制倾向性或突发性安全隐患的有力武器,和日常监管联系紧密、相互贯通。2022年,药品监管专项整治与日常监管齐抓并举,监督检查、监督抽检和监测评价不断加强,质量安全监管的各项工作扎实推进。
这一年,药品监管系统毫不松懈加强疫苗全程监管,持续加强对国家集采中选产品、高风险产品等重点产品和企业的监管,加强“两品一械”网络销售监管,发挥药物警戒的风险防范作用。以集采中选医疗器械监管为例,2022年1月至6月,各省级药监部门集中检查企业221家次、配送企业1371家次、使用单位1万余家次,检查结果显示,相关企业和单位质量管理体系运行情况总体良好。
这一年,药品监管多个方面推出新举措、取得新成效。对于境外药企的远程检查有了更多实践,国家药监局对不符合规范要求的企业亮出“红牌”,根据有关规定,暂停进口、销售和使用相关产品。《关于加强医疗器械生产经营分级监管工作的指导意见》出台,指导基层监管部门落实监管责任,对企业动态调整监管级别。化妆品方面,首次在全国范围内开展风险监测,针对安全风险较高的儿童类、舒缓类、染发类产品,组织开展国家化妆品安全风险监测工作。
蹄疾步稳 促进创新发展
2022年,国家药监局完整、准确、全面贯彻新发展理念,坚持临床导向,巩固深化药品医疗器械审评审批制度改革成果,不断激发医药企业创新活力。
一年来,一批创新药加速上市。用于成人狂犬病毒暴露者的被动免疫的奥木替韦单抗注射液,用于难治性、中重度特应性皮炎成人患者的阿布昔替尼片,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者治疗的卡度尼利单抗注射液,用于改善成人2型糖尿病患者血糖控制的多格列艾汀片……国家药监局“官宣”的15款创新药中,有11款是国产药品,足见我国医药研发整体能力和水平的提升。
2022年获批上市的创新医疗器械再创新高,突破50个,更好满足患者使用高水平医疗器械的需要。其中,质子治疗系统极具代表性。该产品是国家重点研发计划“数字诊疗装备研发”专项的重点支持项目,是我国首台获准上市的国产质子治疗系统,其获批上市标志着我国高端医疗器械装备国产化又迈出一步,肿瘤诊疗再添“国之重器”。
这一年,儿童用药审评审批迎来“小高峰”,全年批准上市儿童药品60余个。一批临床急需产品获批上市,肺动脉高压、白血病、克罗恩病、症状性心力衰竭、癫痫等多个疾病领域的患儿迎来新的治疗选择或适宜剂型,其中不乏填补国内治疗药物空白的产品。
中药传承创新发展也有更多探索,取得可喜成绩。国家药监局成立由两院院士、国医大师、资深专家组成的中药管理战略决策专家咨询委员会,举办国家中药科学监管大会,稳步推进中药民族药标准提高和中药配方颗粒国家标准制定。新药审评审批方面,除有多个中药创新药获批上市外,首个按古代经典名方目录管理的中药复方制剂苓桂术甘颗粒获批上市,推进古代经典名方向新药转化展现出生动实践。
审评审批制度改革深入推进,对于研发和审评具有重要意义的指导原则也日渐完善,这对于改革来说既是成果,也是助力。2022年,国家药监局药审中心发布《同名同方药研究技术指导原则(试行)》《罕见疾病药物临床研究统计学指导原则(试行)》等技术指导原则,包括中药、化学药品和生物制品,涵盖药学、临床、统计、药理毒理等各领域的指导原则体系更为丰富。2022年11月22日,国家药监局器审中心发布《基因测序仪临床评价注册审查指导原则》,我国现行医疗器械注册审查指导原则达500项,指导原则体系迈上新台阶。
久久为功 提升监管能力
法治是保障药品安全的有力武器。2022年,我国药品法规建设蕴藏着汹涌的热流。
一系列“两法两条例”配套文件发布。《药品网络销售监督管理办法》《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》等规章发布实施,行业迎新规。《中药材生产质量管理规范》《医疗器械临床试验质量管理规范》《化妆品生产质量管理规范》等文件出台,监管法规制度更完善。
与此同时,一批业内高度关注的制度文件迎来修订,回应发展需求。
2022年5月9日,《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》正式向社会公开征求意见。此次修订对于贯彻新制修订的法律、全面落实监管要求、解决焦点难点问题意义重大,国家药监局举办系列座谈会,围绕征求意见稿充分听取各方意见建议。
2022年12月23日,《中药品种保护条例(修订草案征求意见稿)》通过国家药监局网站向社会公开,已实施30年的中药品种保护制度的完善迈出了新步伐。征求意见稿在对中成药实施品种保护的基础上将中药饮片、中药材纳入保护,细化纳入保护的具体情形,调整保护等级和期限,并设立中药品种保护退出机制。
加速完善的药品监管法规制度体系,是2022年药品监管能力全面完善的一个侧面。
这一年,中国药品监管科学行动计划持续实施。围绕监管热点、关键环节和共性难题,国家药监局推进首批重点项目成果转化利用和第二批重点项目实施,认定的监管科学研究基地进一步增加到14个。
智慧监管进入新阶段。新版国家化妆品不良反应监测系统上线运行,由国家药监局批准的药品上市许可等证书以及药物非临床研究质量管理规范认证证书发放药品电子注册证,医疗器械电子注册证全面实施。
中国疫苗NRA通过WHO升级评估标准后的新一轮全面评估,证明中国的疫苗监管体系始终保持稳定高效运行。8月23日,WHO在官方网站上官宣并表示祝贺:“由于中国是疫苗生产国,这项成就对全球疫苗供应是极其重要的一步,也是中国公共卫生的重要一步。它将为人们带来更多质量可靠的疫苗,拯救世界各地的生命。”
回望2022,围绕保安全促发展,药品监管各项工作付之于行动、见之于成效。国家药监局用监管给人民群众带来实惠,帮助人民群众解决现实问题,使人民群众享受到改革和发展的成果,努力在新的赶考之路上交出优异答卷。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
为你推荐
-

2023年药品流通行业运行统计分析报告发布 国药、上药、华润位列批发企业前三;国控、大参林、老百姓位列零售企业前三
11月7日,商务部发布《2023年药品流通行业运行统计分析报告发布》。根据报告,2023年,我国药品流通行业规模稳步增长,医药电商交易规模实现持续上涨,药品批发和零售市场集中度进一步提升。 2024-11-28 14:14 -

大医院的药品社区医院买不了?六部门要求分三步解决
11月22日,国家卫生健康委、工业和信息化部、国家医保局、国家中医药局、国家疾控局、国家药监局联合发布《关于改革完善基层药品联动管理机制 扩大基层药品种类的意见》。 2024-11-27 13:47
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有