新修订《医疗器械经营质量管理规范》亮点解析
- 2024-06-27 10:53
- 作者:刘婷婷 黄冠鸿 赵依红
- 来源:中国医药报
医疗器械的质量直接影响医疗器械的安全与有效,关系着人体健康和生命安全。新修订的《医疗器械监督管理条例》于2021年6月1日起施行,首次将加强医疗器械全生命周期质量管理,对研制、生产、经营、使用全过程中医疗器械的安全性、有效性依法承担责任明确规定为医疗器械注册人、备案人的法定义务。随后,《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》《医疗器械临床试验质量管理规范》《企业落实医疗器械质量安全主体责任监督管理规定》等相关法规文件相继制修订,明确和细化了医疗器械全生命周期的质量管理内容和要求。
2023年12月7日,国家药监局发布新修订的《医疗器械经营质量管理规范》(以下简称《规范》),在2014年版质量管理规范的基础上,基于上位法的规定并结合近年来医疗器械产业快速发展而产生的经营新业态和新模式等,针对医疗器械经营环节的质量管理提出更具体、更细化、更完善的要求。
细化质量管理体系相关要求
专设“质量管理体系建立与改进”章节
在现行《医疗器械监督管理条例》等相关法律法规规制下,从事医疗器械经营,应依照法律法规和医疗器械经营质量管理规范的要求,建立健全与所经营医疗器械相适应的质量管理体系并保证其有效运行。《规范》基于上位法的规定,专设了“质量管理体系建立与改进”一章,针对医疗器械经营企业的质量管理体系提出了表1中所列总体要求。
不符合相关要求的潜在影响
需要特别注意的是,《规范》明确质量管理体系的内容包括质量管理体系文件、组织机构、人员、设施设备等,《规范》第三章、第四章和第五章分别对应了相关内容,均有更加细化和具体的要求。质量管理体系文件、组织机构、人员、设施设备等均属于2022年开始施行的新修订《医疗器械经营监督管理办法》第九条规定的从事医疗器械经营活动应具备的条件。若不符合《规范》相关要求,实施许可管理的,将无法取得许可;实施备案管理的,将被责令限期改正,若被认定不能保证产品安全、有效的,将会被取消备案并向社会公告。
此外,违反《规范》有关要求的,主要涉及的法律责任还包括《医疗器械经营监督管理办法》第六十七条和《医疗器械监督管理条例》第八十六条第二款的有关规定,具体情况如表2所示。
进一步明确岗位职责与要求
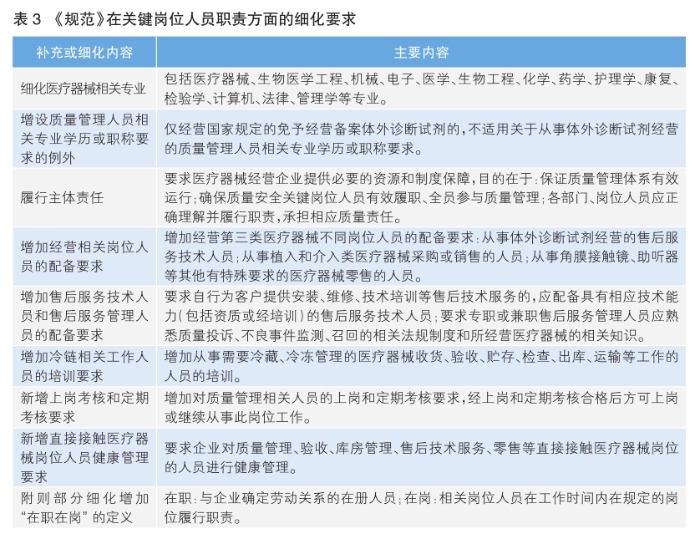
2023年3月1日施行的《企业落实医疗器械质量安全主体责任监督管理规定》,就落实医疗器械注册人、备案人以及医疗器械生产、经营企业质量安全关键岗位人员责任和保障机制等方面提出了具体要求,《规范》在前述上位规定基础上进行了一定的补充与细化,主要涉及如表3所列的细化要求。
值得关注的是,《规范》在人才与培训方面也提出了更为具体的要求,体现了对医疗器械经营人才的高标准、严监管。
明确对临床确认后销售产品有关要求
在临床实践中,有些医疗器械由于使用风险较大及储存、使用要求较高,需要在医疗机构选配后方可确认销售,如骨科植入医疗器械。对此,《规范》第八十九条要求,需要医疗机构选配后方可确认销售的医疗器械,企业应加强出库前的质量复核,符合产品质量安全要求方可出库,并留存出库质量复核记录。医疗机构临床选择确认后,应及时建立销售记录。同时,对于此类医疗器械的退回,《规范》第九十条指出,医疗机构选配后未使用的退回产品,按照本规范第一百零六条、一百零七条进行管理,企业应加强过程质量记录管理,确保医疗机构选配销售产品的出库质量复核记录、销售记录、退货记录信息真实、准确、完整和可追溯。
值得注意的是,由于此类医疗器械一般属于高值医用耗材,因此其销售与使用更容易引发商业贿赂。比如,在上海某医疗器械有限公司商业贿赂案中,当事人自2015年1月起与某医院建立销售关系;2018年3月,该医院新增生物监测设备,以当事人销售的产品进行植入手术前,医院需对产品进行清洗消毒并经生物监测为由,向当事人索要“消毒费”,当事人为了维护客户关系,使该医院继续使用其产品,稳定或扩展销售业务,自2018年4月起,按每台手术450元(加急情况为550元)向该医院支付“消毒费”。尽管该医疗器械经营企业为被动支付所谓“消毒费”,但其行为依旧构成商业贿赂,被罚款人民币10万元并没收违法所得41250.64元。因此,《规范》强调对于此类产品的质量管理要求,有助于减少医疗机构以产品质量存在瑕疵为由索要贿赂。同时,医疗机构及医疗器械经营企业都应注意坚守底线,避免商业贿赂行为。
加强运输、贮存的规范化管理
随着我国物流体系及相关市场的快速发展,在医疗器械经营方面,结合已经发布实施的《国家药品监督管理局关于医疗器械经营企业跨行政区域设置库房办理事项的通告》《医疗器械经营质量管理规范附录:专门提供医疗器械运输贮存服务的企业质量管理》,《规范》第五十二条新增了多仓协同的条款,明确企业可通过跨行政区域设置仓库或委托专门提供医疗器械运输贮存服务的企业贮存等方式,构建全国或区域多仓协同物流管理模式,并具体规定了其质量管理要求。
《规范》第七十一条指出,企业应根据医疗器械的质量特性进行合理贮存,并列明了详细的贮存要求。该条款在2014年版质量管理规范“医疗器械与非医疗器械应分开存放”要求的基础上,进一步明确组合销售的医疗器械和非医疗器械可以不分开贮存;在实施自动化操作的自动化仓库中,医疗器械与非医疗器械可以按货位分开存放。在法规层面为实践中医疗器械与非医疗器械贮存的不同情况提供更细化的操作指引,提高了贮存工作的效率,填补了由于技术发展导致的管理空白。
另外,《规范》要求在库房设置待验区、合格品区、不合格品区、发货区、退货区等有明显区分的区域,在色标管理方面,退货区与待验区均为按照黄色管理。前述内容修改了2014年版质量管理规范中关于“退货产品应单独存放”的要求,该修改对应《规范》第一百零六条关于退换产品管理的新增内容,将有利于衔接质量查验不合格的退货医疗器械放置在不合格品区,按照有关规定采取退货、销毁等处置措施等要求。此外,《规范》针对待验区域提出基于质量特性要求的贮存要求,对于涉及温控要求的医疗器械,则需要注意设置符合不同温控要求的待验区,比如常温、冷藏、冷冻,同时还需要满足避免阳光直射等要求。《规范》对贮存要求的变化如表4所示。
规范新模式、新业态管理
委托销售应委托符合条件的医疗器械经营企业
医疗器械注册人、备案人销售医疗器械的方式包括自行销售和委托销售。在委托销售情形下,《规范》的部分规定对于医疗器械注册人、备案人来说是无法直接执行的。对此,笔者理解,医疗器械注册人、备案人作为质量安全责任主体,即使在委托销售医疗器械时无法直接执行相关规定,仍负有质量安全责任。《规范》第七十九条对此作出了规定,要求医疗器械注册人、备案人应与符合条件的医疗器械经营企业签订委托协议,明确双方的权利和义务,并加强对经营企业的培训和管理。
上述规定与《医疗器械经营监督管理办法》的规定相比,增加了“加强对经营企业的培训和管理”的要求,体现出了强化医疗器械注册人、备案人质量安全主体责任的趋势及要求。
新增对自动售械机的经营管理要求
得益于自动售货机行业在医疗器械领域的快速发展,群众24小时用械需求可通过自动售械机实现,但也同时出现了监管盲区或模糊地带。《规范》将自动售械机划入医疗器械零售经营场所延伸范围,对照医疗器械零售的经营场所要求、陈列要求、贮存要求、销售凭据开具、经营主体和证照展示、公布售后服务电话等方面针对自动售械机提出特殊要求,以确保自动售械机的经营过程在质量可控的状态下运行,保证医疗器械产品经营过程的质量安全。
(作者单位:锦天城律师事务所)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:赵晓菲)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有